
옆집세라 ・ 16시간 전
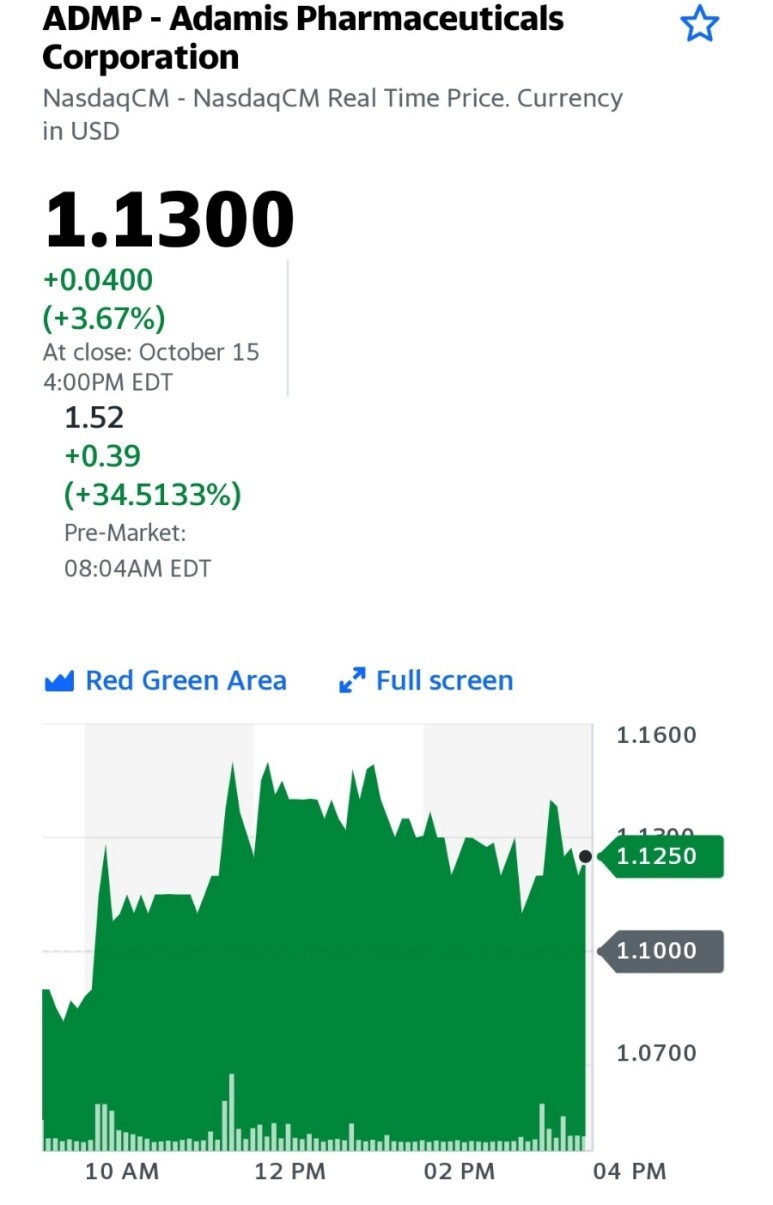
Adamis, ZIMHI에 대한 FDA 승인 획득
Adamis Pharmaceuticals Corporation
2021년 10월 18일 월요일 오후 7:30
오피오이드 과다복용 치료를 위한 새로운 고용량 날록손 제품
SAN DIEGO, Oct. 18, 2021 (GLOBE NEWSWIRE ) -- Adamis Pharmaceuticals Corporation (Nasdaq: ADMP)은 오늘 미국 식품의약국(FDA)이 Adamis의 ZIMHI™(날록손 HCL 주사제, USP) 5mg을 승인했다고 발표했습니다. 0.5mL 제품. ZIMHI는 오피오이드 과다 복용 치료에 사용하도록 FDA 승인을 받은 고용량 날록손 주사 제품입니다.
날록손은 아편유사제 길항제이며 일반적으로 아편유사제 과다복용에 대한 즉각적인 투여를 위한 선택 약물로 간주됩니다. 그것은 극도의 졸음, 느린 호흡 또는 의식 상실을 포함하여 아편유사제의 효과를 차단하거나 역전시켜 작동합니다. 일반적인 아편유사제는 모르핀, 헤로인, 트라마돌, 옥시코돈, 하이드로코돈 및 펜타닐을 포함합니다.
질병통제예방센터(CDC)에서 발표한 통계에 따르면 2021년 3월까지 12개월 동안 미국에서 약물 과다복용으로 인해 약 96,779명이 사망했으며 이는 이전 12개월 동안 29% 증가한 수치입니다. . 약물 과다 복용은 현재 50세 미만 미국인의 주요 사망 원인이며, 펜타닐 및 그 유사체와 같은 보다 강력한 합성 오피오이드가 이러한 사망의 가장 큰 원인이 됩니다.
마취, 진통제 및 중독 제품에 대한 FDA 자문 위원회의 전 위원인 마취과 의사인 Dr. Jeffrey Galinkin은 “이렇게 많이 필요한 고용량 날록손 제품이 대응책으로 치료 도구 키트의 일부가 될 것이라는 사실을 알게 되어 기쁩니다. 펜타닐 관련 사망의 지속적인 급증. ZIMHI에서 날록손의 더 높은 근육 내 투여량은 전신 순환에서 더 빠르고 더 높은 수준의 날록손을 가져와 더 성공적인 소생술을 초래할 것입니다.”
Adamis의 사장 겸 CEO인 Dr. Dennis J. Carlo는 다음과 같이 말했습니다. ZIMHI는 현재 사용 가능한 비강 또는 근육 내 제품과 비교하여 가장 높은 전신 수준의 날록손을 제공합니다.”
US WorldMeds의 CEO인 P. Breckinridge Jones, Sr.은 다음과 같이 덧붙였습니다. 미국 WorldMeds는 의약품을 성공적으로 상용화한 입증된 실적을 보유하고 있으며 갑작스러운 아편유사제 중단과 관련된 금단 증상의 치료를 위한 최초이자 유일한 FDA 승인 제품인 LUCEMYRA ® (로펙시딘)를 보유하고 있습니다. 우리는 우리의 기존 상업 기반 시설과 오피오이드 의존 시장에서의 입지를 활용하여 ZIMHI의 도입을 가속화하고 증가하는 오피오이드 위기에 대처할 수 있다고 확신합니다. 2022년 1분기로 예정된 ZIMHI의 정식 상용화를 준비하고 있다”고 말했다.
Adamis Pharmaceuticals 소개
Adamis Pharmaceuticals Corporation은 주로 알레르기, 아편유사제 과다복용, 호흡기 및 염증성 질환을 포함한 다양한 치료 분야에서 제품 개발 및 상용화에 주력하는 전문 바이오 제약 회사입니다. 회사의 SYMJEPI(에피네프린) 주사 제품은 아나필락시스를 포함한 급성 알레르기 반응의 응급 치료에 사용하도록 FDA 승인을 받았습니다. 회사의 ZIMHI(날록손) 주사 제품은 오피오이드 과다복용 치료에 승인되었습니다. Tempol은 COVID-19 환자 치료를 위해 개발 중이며 2/3상 임상 시험이 진행 중입니다.
ZIMHI™ 정보(날록손 HCL 주사제, USP) 5 mg/0.5 mL
ZIMHI는 호흡 문제 및 심한 졸음 또는 반응할 수 없는 징후가 있는 과다 복용 또는 가능한 과다 복용과 같은 오피오이드 응급 치료를 위해 성인 및 어린이에게 사용되는 처방약입니다. ZIMHI는 간병인이 즉시 제공해야 하며 응급 의료를 대신하지 않습니다.
LUCEMYRA ® (로펙시딘) 정보
경구 정제인 LUCEMYRA ® (로펙시딘)는 노르에피네프린의 방출을 감소시켜 아편유사제 금단 현상을 유발하는 신경화학적 급증을 억제하는 중심 알파 2-아드레날린 작용제입니다. 성인의 갑작스러운 아편유사제 중단을 촉진하기 위해 아편유사제 금단 증상의 완화를 위해 표시됩니다. 임상 시험에서 LUCEMYRA ® 는 오피오이드 금단 현상을 경험한 환자가 보고한 바와 같이 위약에 비해 금단 증상의 심각성을 유의하게 감소시켰습니다. LUCEMYRA ® 는 일반적으로 최대 금단 증상 기간(일반적으로 아편유사제 마지막 사용 후 5~7일) 동안 5~6시간 간격으로 1일 4회 0.18mg 3정을 경구 복용합니다. 전체 치료는 최대 14일 동안 계속될 수 있습니다. 루체미라® 은 2-4일에 걸쳐 점진적으로 용량을 감량하면서 중단해야 합니다.
https://finance.yahoo.com/news/adamis-receives-fda-approval-zimhi-113000260.html
'미국주식' 카테고리의 다른 글
| [미국 주식]Energous Corporation (WATT,에너거스 코퍼레이션) (0) | 2021.10.19 |
|---|---|
| [미국 주식] Atea Pharmaceuticals, Inc.(AVIR) 주가가 급락한 이유는? (0) | 2021.10.19 |
| [미국 주식] Aerovate Therapeutics, Inc.(AVTE, 에어로베이트 테라퓨틱스) (0) | 2021.10.19 |
| [미국 주식] Siyata Mobile Inc (SYTAW) 주가가 급등한 이유는? (0) | 2021.10.19 |
| [미국 주식] Adamis Pharmaceuticals Corporation (ADMP) 주가가 급등한 이유는? (0) | 2021.10.18 |


댓글