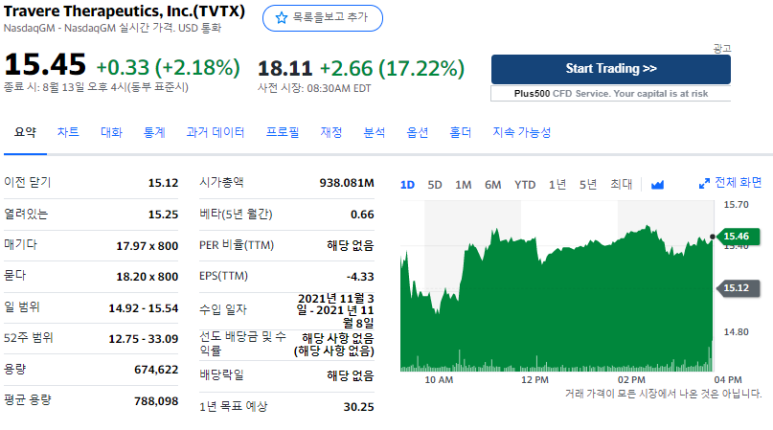
Travere Therapeutics, IgA 신증에서 스파센탄에 대한 진행 중인 3상 PROTECT 연구의 긍정적인 Topline 중간 결과 발표
Travere Therapeutics, Inc.
2021년 8월 16일 월요일 오후 7:00
Sparsentan 치료 그룹은 36주 후 기준선에서 평균 49.8%의 단백뇨 감소를 경험했으며, 이는 활성 대조약의 3배 이상 감소했습니다. 중간 1차 효능 종료점 달성, p<0.0001
현재까지 연구에서 스파센탄은 일반적으로 내약성이 우수하고 이전에 관찰된 안전성 프로파일과 일치했습니다.
2022년 상반기에 미국에서 Subpart H에 따른 NDA 제출 가속화된 승인 경로
회사, 오늘 오전 8시 30분(동부 표준시)에 전화 회의 및 웹캐스트 개최
샌디에고, Aug. 16, 2021 (GLOBE NEWSWIRE) -- Travere Therapeutics, Inc.(NASDAQ: TVTX)는 오늘 IgA 치료제 후보물질인 스파센탄에 대한 진행 중인 중추적인 3상 PROTECT 연구의 긍정적인 톱라인 중간 결과를 발표했습니다. 신병증(IgAN). PROTECT 연구는 활성 대조군 irbesartan과 비교하여 치료 36주 후 기준선에서 단백뇨의 3배 이상 감소를 입증하여 통계적 유의성으로 사전 지정된 중간 1차 효능 평가변수를 충족했습니다(p<0.0001). 중간 분석의 예비 결과는 연구에서 현재까지 스파센탄이 일반적으로 내약성이 우수하고 현재까지 관찰된 안전성 프로파일과 일치함을 시사합니다. 잠정분석 결과를 바탕으로 미국에서 가속승인 신청서를 제출할 예정이다.
Travere Therapeutics의 CEO인 Eric Dube 박사는 “IgAN은 말기 신장 질환의 주요 원인이며 이 치명적인 희귀 신장 질환의 진행을 늦추기 위한 새로운 치료 옵션이 분명히 필요합니다. “PROTECT 연구의 이러한 데이터는 단백뇨를 현저히 감소시키는 스파센탄의 능력을 입증하고 승인될 경우 IgAN과 함께 사는 사람들을 위한 새로운 기초 치료제가 될 가능성을 뒷받침합니다. 우리는 이 진행중인 연구에서 고품질을 유지하기 위해 계속 노력할 것이며 내년 상반기부터 가속화된 승인 제출을 준비하면서 규제 기관과 협력하기를 기대합니다.”
사전 지침에 따라 회사는 진행중인 연구에서 시험 무결성을 유지하기 위해 중간 분석에서 제한된 데이터를 제공합니다. PROTECT 연구에서 활성 ACE 또는 ARB 치료에도 불구하고 지속적인 단백뇨가 있는 총 404명의 환자가 활성 대조군인 스파센탄 또는 이르베사르탄을 1일 1회 경구 용량으로 1:1로 무작위 배정했습니다. 연구 프로토콜은 첫 번째 280명의 환자를 무작위 배정한 후 약 36주에 36주차 기준선에서 단백뇨(소변 단백질 대 크레아티닌 비율)의 변화인 1차 유효성 평가변수를 평가하기 위해 맹검 중간 분석을 제공했습니다. 치료 36주 후, 스파센탄을 투여받은 환자는 기준선에서 단백뇨가 평균 49.8% 감소한 반면, 기준선에서 단백뇨가 평균 15% 감소했습니다.
Travere Therapeutics의 최고 의료 책임자인 Noah Rosenberg 박사는 "Sparsentan은 현재까지 IgAN에 대한 가장 큰 중재 연구 중 하나에서 현재 표준 치료에 비해 통계적으로 강력하고 임상적으로 의미 있는 단백뇨 감소를 입증했습니다. “이 데이터는 FSGS의 2상 DUET 및 3상 DUPLEX 연구를 기반으로 하며 희귀 신장 장애를 위해 개발 중인 이중 엔도텔린-안지오텐신 수용체 길항제로서 스파센탄을 사용한 새로운 접근 방식에 대한 지원을 더욱 강화합니다. IgAN에서 진행 중인 이 획기적인 연구에 계속 참여하는 모든 환자, 가족, 조사관 및 현장 직원에게 감사를 전하고 싶습니다.”
2차 유효성 평가변수에는 58주 및 110주 기간 동안 무작위 치료 개시 후 추정 사구체 여과율(eGFR)의 변화율과 52주 및 104주 기간에 걸친 eGFR 변화율이 포함됩니다. 무작위 치료의 첫 6주 후. 회사는 중간 분석 시점에 입수할 수 있는 예비 eGFR 데이터가 2년 치료 후 잠재적으로 임상적으로 의미 있는 치료 효과를 나타낸다고 믿습니다. 연구 프로토콜에 따라 환자는 확인 종료점 분석에서 110주 동안 eGFR 기울기에 대한 치료 효과를 완전히 평가하기 위해 PROTECT 연구에서 맹검 방식으로 계속됩니다. 확증적 종말점 분석의 톱라인 결과는 2023년 하반기에 나올 것으로 예상됩니다.
중간 안전성 결과에 대한 예비 검토는 연구에서 현재까지 두 치료 그룹 모두 일반적으로 내약성이 우수했으며 스파센탄은 새로운 안전성 신호가 나타나지 않고 이전에 관찰된 안전성 프로파일과 일치하는 것으로 나타났습니다.
회사는 또한 2021년 3분기 동안 국소 분절 사구체 경화증(FSGS) 치료를 위한 스파센탄의 중추적인 3상 DUPLEX 연구에 대한 규제 업데이트를 제공하기 위해 순조롭게 진행 중입니다.
컨퍼런스 콜 정보
Travere Therapeutics는 연구 결과에 대해 논의하기 위해 2021년 8월 16일 월요일 오전 8시 30분(동부 표준시)에 컨퍼런스 콜 및 웹캐스트를 개최합니다. 전화 회의에 참여하려면 동부 표준시 오전 8시 30분 직전에 +1(855) 219-9219(미국) 또는 +1(315) 625-6891(국제), 확인 코드 9558913으로 전화를 겁니다. 웹캐스트는 travere.com의 투자자 및 미디어 페이지의 이벤트 및 프레젠테이션 섹션에서 액세스할 수 있으며 최소 30일 동안 보관됩니다. 통화 재생은 2021년 8월 16일 오전 11시 30분(동부 표준시)부터 2021년 8월 23일 오전 11시 30분(동부 표준시)까지 가능합니다. 재생 번호는 +1 (855) 859-2056(미국) 또는 +1입니다. (404) 537-3406(국제), 확인 코드 9558913.
PROTECT 연구 정보
진행중인 PROTECT 연구는 IgAN에서 현재까지 가장 큰 중재 연구 중 하나입니다. IgAN 및 지속적인 18세 이상의 환자 404명을 대상으로 irbesartan 300mg과 비교하여 sparsentan 400mg의 안전성과 효능을 평가하는 글로벌, 무작위, 다기관, 이중 맹검, 평행군, 능동 대조 임상 시험입니다. 사용 가능한 ACE 또는 ARB 요법에도 불구하고 단백뇨. PROTECT 연구 프로토콜은 치료 36주 후 최소 280명의 환자에 대한 비맹검 중간 분석을 제공하여 1차 유효성 평가변수(기준선에서 36주차의 단백뇨(소변 단백질 대 크레아티닌 비율)의 변화)를 평가합니다. 2차 유효성 평가변수에는 58주 및 110주 기간 동안 무작위 치료 시작 후 eGFR의 변화율이 포함됩니다.
스파센탄 소개
이중 엔도텔린 안지오텐신 수용체 길항제(DEARA)인 Sparsentan은 새로운 연구 제품 후보입니다. 전임상 데이터에 따르면 희귀 만성 신장 질환의 형태로 엔도텔린 A형 및 안지오텐신 II형 1형 경로를 모두 차단하면 단백뇨가 감소하고 족세포가 보호되며 사구체 경화증 및 간세포 증식이 예방됩니다. Sparsentan은 미국과 유럽에서 IgAN 및 FSGS 치료제로 희귀의약품 지정을 받았습니다.
Sparsentan은 현재 국소 분절 사구체 경화증(FSGS) 치료를 위한 중추적인 3상 DUPLEX 연구와 IgAN 치료를 위한 중추적인 3상 PROTECT 연구에서 평가되고 있습니다. 2021년 2월, 회사는 FSGS에서 스파센탄에 대한 진행 중인 중추적인 3상 DUPLEX 연구에서 사전에 지정된 FSGS 단백뇨 종점(FPRE)의 부분 관해를 통계적으로 유의미하게 달성했다고 발표했습니다. FPRE는 요단백 대 크레아티닌 비율(UP/C)이 1.5g/g 이하이고 기준선에서 UP/C가 40% 이상 감소하는 것으로 정의되는 임상적으로 의미 있는 종점입니다. 치료 36주 후, sparsertan을 투여받은 환자의 42.0%가 FPRE를 달성한 반면, irbesartan 투여 환자의 26.0%(p=0.0094)와 비교하여 FPRE를 달성했습니다. 중간 분석의 예비 결과는 중간 평가 당시, sparsentan은 일반적으로 내약성이 우수했으며 irbesartan과 유사한 안전성 프로파일을 보였습니다. FSGS의 스파센탄에 대한 2상 DUET 연구에서, 복합 치료 그룹은 1차 효능 평가변수를 충족하여 이르베사르탄에 비해 단백뇨가 2배 이상 감소했으며 8주간의 이중 맹검 치료 후에 일반적으로 내약성이 우수했습니다. 기간. Irbesartan은 승인된 약리학적 치료법이 없는 경우 FSGS 및 IgAN을 관리하는 데 사용되는 약물 종류의 일부입니다. 두 적응증 모두에 대해 승인된다면 스파센탄은 잠재적으로 FSGS와 IgAN 모두에 대해 승인된 최초의 의약품이 될 수 있습니다. 이르베사르탄에 비해 단백뇨가 2배 이상 감소했으며 일반적으로 8주간의 이중 맹검 치료 기간 후에 내약성이 우수했습니다. Irbesartan은 승인된 약리학적 치료법이 없는 경우 FSGS 및 IgAN을 관리하는 데 사용되는 약물 종류의 일부입니다. 두 적응증 모두에 대해 승인된다면 스파센탄은 잠재적으로 FSGS와 IgAN 모두에 대해 승인된 최초의 의약품이 될 수 있습니다. 이르베사르탄에 비해 단백뇨가 2배 이상 감소했으며 일반적으로 8주간의 이중 맹검 치료 기간 후에 내약성이 우수했습니다. Irbesartan은 승인된 약리학적 치료법이 없는 경우 FSGS 및 IgAN을 관리하는 데 사용되는 약물 종류의 일부입니다. 두 적응증 모두에 대해 승인된다면 스파센탄은 잠재적으로 FSGS와 IgAN 모두에 대해 승인된 최초의 의약품이 될 수 있습니다.
Travere Therapeutics 소개
Travere Therapeutics에서 우리는 평생 희귀합니다. 우리는 매일 함께 모여 모든 배경의 환자, 가족 및 간병인이 희귀 질환을 앓고 있는 삶을 헤쳐 나갈 수 있도록 돕습니다. 이 경로에서 우리는 치료 옵션의 필요성이 시급하다는 것을 알고 있습니다. 이것이 바로 우리의 글로벌 팀이 희귀 질환 커뮤니티와 협력하여 삶을 변화시키는 치료법을 식별, 개발 및 제공하는 이유입니다. 이 사명을 추구하기 위해 우리는 희귀 환자의 다양한 관점을 이해하고 용감하게 새로운 길을 개척하여 그들의 삶을 변화시키고 오늘과 내일의 희망을 제공하기 위해 지속적으로 노력합니다.
https://finance.yahoo.com/news/travere-therapeutics-announces-positive-topline-110000690.html
'미국주식' 카테고리의 다른 글
| [미국 주식] NanoVibronix, Inc.(NAOV) 주가가 급등한 이유는? (0) | 2021.08.16 |
|---|---|
| [미국 주식]McAfee Corp. (MCFE) (0) | 2021.08.16 |
| [미국 주식] Jupiter Wellness, Inc.(JUPWW) 주가가 급등한 이유는? (0) | 2021.08.16 |
| [미국 주식] CohBar, Inc. (CWBR) 주가가 급등한 이유는? (0) | 2021.08.11 |
| [미국 주식] Good Times Restaurants Inc. (GTIM) 주가가 급등한 이유는? (0) | 2021.08.11 |




댓글