Entera Bio, 1 차 및 주요 2 차 평가 변수를 충족 한 EB613에 대한 우수한 Topline Phase 2 BMD 데이터 발표
Entera Bio Ltd.
2021 년 6 월 23 일 (수) 오후 8시 30 분·
2.5mg 용량의 EB613을 투여받은 피험자는 6 개월에 요추, 엉덩이 전체 및 대퇴부 경부에서 BMD가 용량 관련 유의미한 증가를 보였습니다.
2.5mg 용량의 EB613을 6 개월 동안받은 피험자는 요추 BMD에서 3.78 %의 유의 한 위약 조정 증가를 보였습니다 (p <0.008).
연구의 1 차 유효성 평가 변수 인 이전에보고 된 바와 같이 3 개월에 P1NP가 통계적으로 유의미하게 증가했습니다.
EB613은 약물 관련 심각한 부작용없이 우수한 안전성 프로필을 보였습니다.
EB613 개발 프로그램을 검토하기 위해 FDA와의 2 단계 회의가 다음 달에 끝날 것으로 예상됩니다. Forteo 치료 대 EB613 투여 한 환자에서 요추 골밀도의 변화를 비교하는 하나의 중요한 한 해 3 단계 연구를 수행 할 계획이다 ® 505 (b)에 따라, (2) 경로를
EB613은 골다공증 치료를위한 최초의 구강 뼈 형성 제제로 자리 매김했습니다.
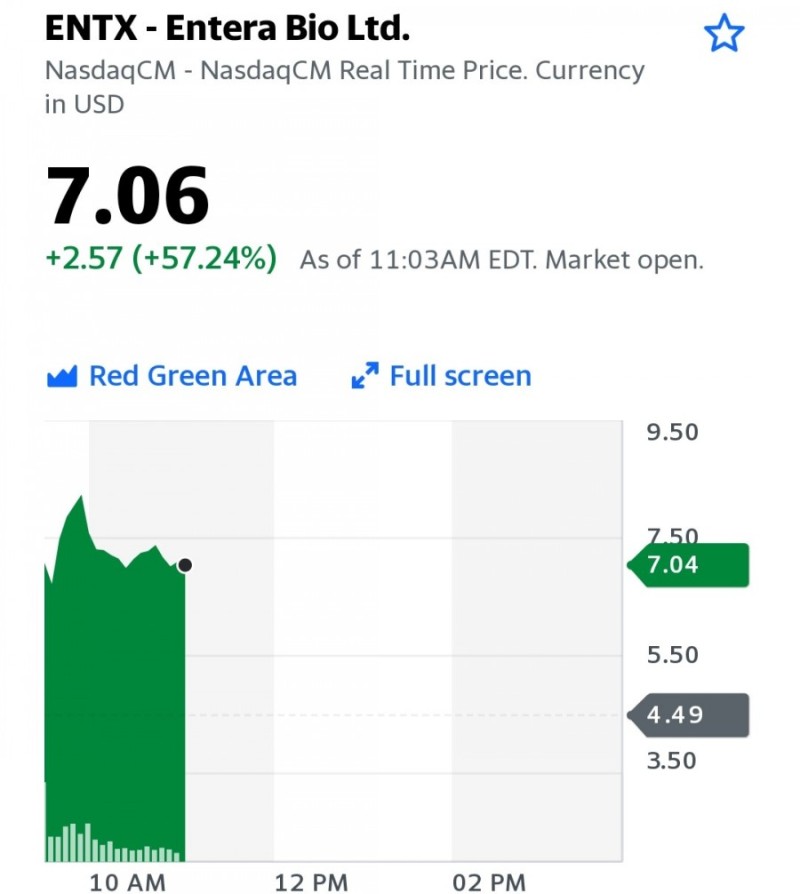
BOSTON 및 JERUSALEM, 2021 년 6 월 23 일 (글로벌 뉴스 와이어)-구강 전달 대형 분자 및 생물학적 치료제 개발의 선두 주자 인 Entera Bio Ltd. (NASDAQ : ENTX), 최종 6 개월 골밀도 (BMD) 발표 골다공증 치료를위한 EB613 임상 2 상 완료 결과. EB613은 인간 부갑상선 호르몬 (1-34) 또는 PTH의 경구 제형으로 골다공증 환자를 치료하는 최초의 구강 뼈 형성 (단백 동화) 제품으로 자리 매김했습니다. 현재, 모든 형태의 치료를받는 골다공증 환자의 5 % 미만이 주사 가능한 단백 동화 제로 치료를 받고 있으며 가장 효과적인 치료 형태로 널리 인정되고 있습니다 1. EB613의 2 상 임상 시험은 골다공증이 있거나 골밀도 (BMD)가 낮은 161 명의 폐경기 여성 피험자를 대상으로 한 6 개월 이중 맹검, 용량 범위 위약 대조 연구였습니다. 이 연구는 다양한 용량의 EB613의 안전성과 효능을 평가하기 위해 이스라엘의 4 개 주요 의료 센터에서 수행되었습니다. 바이오 마커와 안전 모니터링을 포함한 모든 실험실 테스트는 인증 된 중앙 실험실에서 수행되었으며 임상 현장의 BMD 데이터는 독립적으로 인증 된 글로벌 이미징 센터에서 분석되었습니다.
가장 중요한 BMD 종점 인 6 개월 후 요추 (LS) BMD의 변화가 충족되었습니다. LS BMD, 대퇴 경부 및 전체 고관절 BMD의 증가에서 통계적으로 유의 한 용량 관련 경향이 있었으며, EB613 2.5mg으로 치료 한 피험자에서 가장 큰 증가가 관찰되었습니다. 골 형성의 생화학 적 마커의 용량 의존적 증가는 이전에보고되었습니다. 요추 (LS) BMD의 유의 한 증가는 1.5mg 그룹, 적정되지 않은 2.5mg 그룹 (전체 6 개월 동안 2.5mg을 투여받은 그룹) 및 적정 된 2.5mg 그룹 (적정 중 더 낮은 용량을 투여받은 그룹)에서 관찰되었습니다. 및 4 개월 동안 2.5mg). LS BMD의 증가는 FDA가 Entera의 pre-IND 회의에서 설명한대로 505 (b) (2) 경로의 1 차 평가 변수입니다.® ( "참조 약물"), 요추 골밀도 증가에 대한 비열 등성을 달성하기 위해 고안되었습니다.
유사한 환자 집단을 대상으로 수행 된 이전 Forteo ® 연구 에서 6 개월에 관찰 된 LS BMD 대 위약의 증가 는 3.9 % 범위에있었습니다 2 . 현재 연구에서 LS BMD는 전체 6 개월 동안 2.5mg을 투여 한 그룹에서 3.78 % (p <0.008) 증가했습니다. 이 그룹을 적정 2.5mg 그룹 (적정 중 저용량, 단 4 개월 동안 2.5mg 투여)과 결합했을 때 LS 척추 BMD가 2.73 % 증가했습니다 (p <0.002).
또한, EB613은 6 개월에 대퇴 경부 및 전체 고관절 골밀도에 상당한 영향을 미쳤습니다. 2.5mg EB613 치료군은 위약에 비해 대퇴 경부 2.76 % (p <0.002) 증가, 6 개월에 전체 엉덩이가 1.84 % (p <0.02) 증가했습니다. 대조적으로, 대퇴 경부 골밀도 및 전체 고관절의 현저한 증가는 일반적으로 6 개월에 Forteo ® 치료로 관찰되지 않습니다 . 고관절 BMD의 증가는 비 척추 골절 위험의 감소와 관련이있는 것으로 나타났습니다 3 .
이 용량 범위 연구에서, 다양한 용량의 EB613이 3 개월 후 골대사 마커에 미치는 영향과 6 개월 후 요추, 대퇴 경부 및 엉덩이 전체의 골밀도에 미치는 영향을 테스트했습니다. 피험자들은 처음에 EB613 0.5mg, 1.0mg, 1.5mg 또는 일치하는 위약을 매일 1 회 경구 투여하도록 무작위 배정되었습니다. 이 연구는 치료 1 개월 후 P1NP (골 형성 마커)의 상당한 용량 관련 증가를 입증 한 치료를받은 처음 80 명의 피험자에서 3 개월 바이오 마커 변화에 대한 제한된 중간 분석과 함께 적응 설계를 사용했습니다. 중간 데이터 분석에 기초하여 2.5mg 용량이 도입되었습니다.
이전에보고 된 바와 같이, 임상 시험의 1 차 평가 변수가 충족되었습니다. 임상 시험의 완전한 3 개월 결과는 위약에 비해 치료 3 개월 후 (P <0.04) 2.5mg 용량 그룹에서 P1NP 바이오 마커가 유의하게 증가한 것으로 나타났습니다. P1NP는 새로운 뼈 형성 속도를 나타내는 바이오 마커입니다.
이 시험의 2 차 평가 변수는 Osteocalcin과 CTX를 포함하여 3 개월에 몇 가지 추가 혈청 뼈 바이오 마커에 대한 치료 효과를 포함했습니다. P1NP와 유사하게 Osteocalcin은 새로운 뼈를 만드는 세포 인 조골 세포에 의한 뼈 형성을위한 바이오 마커입니다. CTX는 오래된 뼈를 제거하는 세포 인 파골 세포에 의한 뼈 흡수율을 나타내는 바이오 마커입니다. 골 동화 작용 또는 뼈 형성 효과는 뼈 형성과 뼈 흡수의 차이에 기반합니다. 예를 들어, CTX의 작은 증가 (또는 감소)와 관련된 P1NP 또는 Osteocalcin의 증가는 일반적으로 골 질량의 증가를 초래합니다.
P1NP 및 Osteocalcin의 증가와 함께 취해진 CTX의 감소는 6 개월 BMD 결과에 반영된 바와 같이 BMD에 대한 잠재적 인 긍정적 영향과 골절 위험 감소를 나타내며, 이는 단백 동 화성 골다공증 치료의 목표입니다.
연구 약물 인 EB613은 일반적으로 치료 6 개월 동안 잘 견뎌냈습니다. 어떤 치료 그룹에서도 강도가 심한 이상 반응은 없었으며 심각한 약물 관련 이상 반응은 없었습니다. 그러나 2.5mg 용량의 EB613에 무작위 배정 된 피험자는 더 높은 비율의 이상 반응 (AE)을 보였으며, 이는 메스꺼움, 두통 및 현기증 (또는 실신 전)과 같은 PTH의 일일 주사와 관련된 것으로 알려진 이상 반응과 일치합니다. . 임상 연구 환경에서, 심각한 골다공증이 아닌 피험자와 COVID 대유행으로 인해 임상 연구에 남아있는 것을 더 망설이는 피험자들과 함께 이러한 예상되는 AE 중 일부는 피험자가 동의를 철회하게했습니다. 경구 치료의 장점 중 하나를 활용하여 프로토콜 수정을 통해 새로운 적정 요법이 도입되었습니다. 2.5mg 용량 (또는 매칭 위약)으로 무작위 배정 된 피험자는 1.5mg 용량으로 치료를 시작한 다음 1 개월 진료 방문시 2.0mg 용량을 투여하고 궁극적으로 3 개월 클리닉 방문시 2.5mg 용량을 시작했습니다. 이 적정 요법은 COVID-19 전염병에도 불구하고 전체 예상 비율 인 20 % 이내 인 피험자의 중퇴를 초래하는 부작용을 최소화했습니다.
“우리는 잠재적 인 전략적 파트너와의 논의를 진행하는 데 도움이 될 이러한 훌륭한 결과에 매우 흥분하고 격려합니다. 이러한 결과는 이전에보고 된 바이오 마커 결과와 일치하며 Entera의 플랫폼 기술과 경구 약물의 혜택을받을 수있는 다양한 적응증에 대해 다양한 큰 분자의 경구 제형을 가능하게하는 잠재력을 더욱 검증합니다.”라고 Entera Bio의 CEO 인 Spiros Jamas가 말했습니다. . “우리는 FDA와의 2 단계 회의가 끝나기를 고대하고 있습니다. 더 자세한 결과는 향후 과학 컨퍼런스 및 출판물에서도 발표 될 것입니다. 회사는 특히 고관절 골밀도 증가와 관련된 잠재적 인 추가 골다공증 시장 기회를 평가할 것입니다.”
EB613 정보
EB613은 경구 전달 인간 부갑상선 호르몬 (1-34) 또는 PTH, 1 일 1 회, 골다공증 환자를위한 구강, 뼈 형성 (단백 동화) 치료의 첫 번째 잠재력으로 자리 잡은 약물 후보입니다. 주 사용 Teriparatide (포르테 오 (Forteo ® ) 라는 브랜드로 판매 )는 골절 위험이 높은 남성과 폐경기 여성의 골다공증 치료를 위해 2002 년 미국에서 승인되었으며 매일 피하 주사를 통해 복용합니다.
골다공증에 대해
골다공증은 골질량이 낮고 뼈 조직이 구조적으로 악화되어 취약성이 커지고 골절 위험이 증가하는 질환입니다. 골다공증은 또한 조용한 질병으로, 골절이 발생할 때까지 징후 나 증상이없는 경우가 많으며, 대부분의 환자는 진단과 치료를받지 못하며 충족되지 않은 의료 요구가 높습니다. 골다공증의 쇠약 효과는 상당한 비용을 초래하고 골다공증 골절은 상당한 의료 부담을 만듭니다. 미국에서 매년 약 200 만 건의 골다공증 골절이 발생하며,이 수치는 2025 년까지 300 만 건으로 증가 할 것으로 예상됩니다. 국립 골다공증 재단 (NOF)은 이미 8 백만 명의 여성이 골다공증을 앓고 있다고 추정했습니다. 또 다른 약 4 천 4 백만은 골질량이 낮아 골다공증 위험이 증가 할 수 있습니다. 55 세 이상의 미국 여성의 경우 골다공증 골절 및 인구 시설 관련 병원 비용으로 인한 입원 부담이 심근 경색, 뇌졸중 또는 유방암보다 더 큽니다.
Entera Bio Ltd. 정보
Entera는 환자의 비용, 편의성 및 순응도 문제로 인해 주 사용 요법의 채택이 제한되어있는 미충족 의료 요구가 큰 분야에서 사용하기위한 경구 전달 대형 분자 치료제 개발의 선두 주자입니다. 회사의 독점적 인 경구 약물 전달 기술은 흡수율이 낮고, 가변성이 높으며, 합성 흡수 증진제를 사용하여 신체의 표적 위치에 큰 분자를 전달하지 못하는 기술적 문제를 해결하여 큰 물질의 흡수를 촉진하도록 설계되었습니다. 분자 및 프로테아제 억제제를 사용하여 효소 분해를 방지하고 표적 조직으로의 전달을 지원합니다. 회사의 가장 앞선 제품 후보 인 골다공증 치료 용 EB613과 부갑상선 기능 저하증 치료 용 EB612는 임상 2 상 단계에 있습니다.
https://finance.yahoo.com/news/entera-bio-announces-excellent-topline-123000249.html
Entera Bio Announces Excellent Topline Phase 2 BMD Data for EB613, the Study Met Its Primary and Key Secondary Endpoints
Subjects receiving the 2.5 mg dose of EB613 showed significant dose-related increases in BMD at the lumbar spine, total hip, and femoral neck at 6 monthsSubjects receiving the 2.5 mg dose of EB613 for 6 months had a significant placebo adjusted increase of
finance.yahoo.com
'미국주식' 카테고리의 다른 글
| [미국 주식] Arcus Biosciences, Inc (RCUS) 주가가 급등한 이유는? (0) | 2021.06.24 |
|---|---|
| [미국 주식] Orphazyme A/S (ORPH) 주가가 급등한 이유는? (0) | 2021.06.24 |
| [미국 주식] Torchlight Energy Resources, Inc (TRCH) 주가가 급등한 이유는? (0) | 2021.06.22 |
| [미국 주식] Luokung Technology Corp (LKCO, 루오쿵 테크놀로지) 주가가 급등한 이유는? (0) | 2021.06.22 |
| [미국 주식] Lydall, Inc.(LDL, 리달) 주가가 급등한 이유는? (0) | 2021.06.22 |




댓글